Chemische Wirkung von Kalk im Boden
- Reaktion von CaCO₃, CaMg(CO₃)₂ oder CaO mit Wasser (H₂O)
- Entstehung des Puffersystems durch Reaktion mit CO₂
- Binden von H⁺-Ionen (Säuren)
- Neutralisation von H⁺-Ionen zu neutralem Wasser (H₂O)
- Bildung von Calcium- oder Magnesium-Verbindungen
- Steigerung des pH-Werts im Boden
- Versauerung nimmt ab – verbesserte Nährstoffverfügbarkeit
Puffersystem mit Kalk
Fehlt das natürliche oder gedüngte Ca-Carbonat → Kohlensäure wirkt bodenversauernd und senkt den pH-Wert ab
Für weitere Informationen zum Puffersystem im Boden und den unterschiedlichen Puffersystemen.
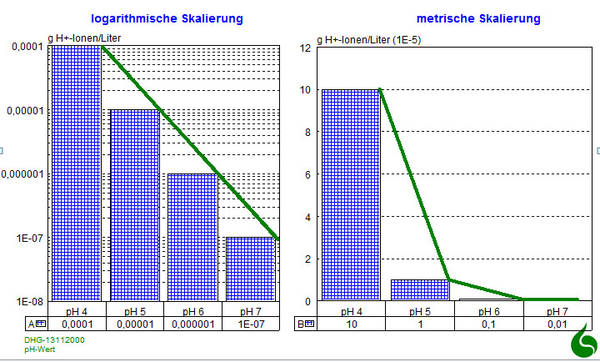
Der pH-Wert
- negative dekadische Logarithmus (= Zehnerlogarithmus) der Wasserstoffionen-Aktivität und somit eine dimensionslose Zahl.
- Maßstab für den sauren oder basischen Charakter einer wässrigen Lösung bzw. des Bodens.
- Bestimmung Säuregrades von Böden und somit Ermittlung des Kalkbedarfes.
Weitere Informationen zum pH-Wert.
Ein Absenken des pH-Wertes um eine Einheit bedeutet daher ein Verzehnfachen der Säurekonzentration bzw. bei zwei Einheiten ein Verhundertfachen.
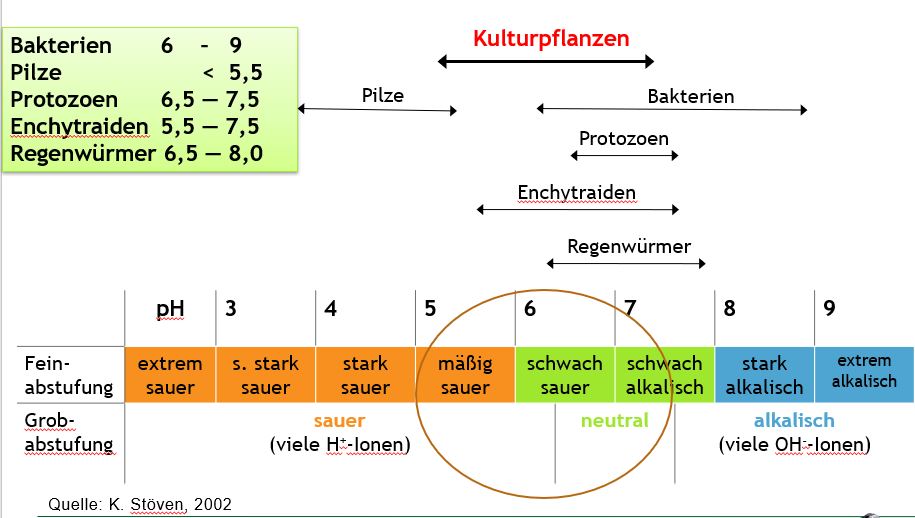
Optimale pH-Werte für Kulturpflanzen und Bodenlebewesen